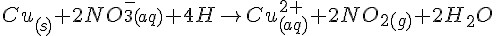Afstemning af redoxreaktioner i vandig opløsning

| Kemi
Dette er en artikel der er relateret til faget kemi. |
Her gennemgår vi hvordan man afstemmer en redoxreaktion i en vandig opløsning. Der vigtigste er at afstemme oxidationstallene på begge sider af reaktionen.
Eksempel
Eksempel hvor man blander Salpetersyrer og kobber.
- Salpetersyre (HNO3)
- Salpetersyre bliver opløst i ionerne:
- H
- NO3
- Kobber (Cu)
- Reaktion
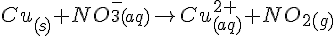
- Oxidationstal
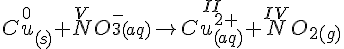
- N har først et oxidationstal på 5 og bagefter en på 4.
- Cu har først et oxidations tal på 0 og bagefter på 2.
Da Cu vil afgive 2 elektroner skal der være 2 NO3 ioner i reaktionen, fordi det hele skal gå op. Derfor vil det se sådan ud:
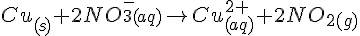
Da der også er 2 oxygen molekyler i overskud skal vi tilføje 4 H molekyler for at få reaktionen til at gå på: