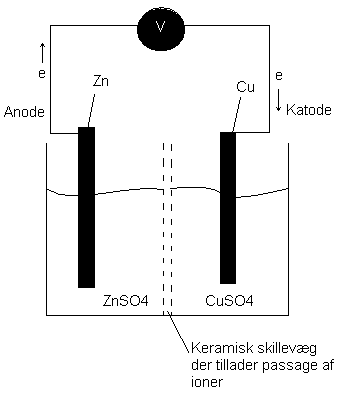
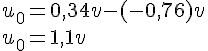I et galvanisk element sker en spontan redoxreaktion, hvor kemisk energi omdannes til elektrisk energi.
Derved
- Ligevægt for reaktioner
-
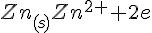
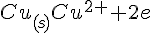
Negativ pol = Anode, re
Positiv pol = Katode, ox
Derved kommer vi frem til følgende
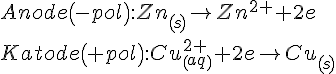
Udregning af spænding
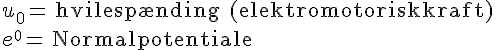
- Formel
-
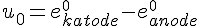
- Udregning
-