Kemi Forsøg Spændingsrækken
Indholdsfortegnelse |
Forsøgsrække
Oversigt over de forsøg som vi har tænkt os at udføre for at eftervise spændingsrækken.
- f
- Forsøg udføres og resultat observeres.
- x
- Forsøget er ikke relevant.
- (b)
- Resultat giver sig selv fordi modstående forsøg er udført.
- F.eks: Når MgCl2 + Ag giver en reaktion, kan AgNO3 + Mg ikke give en reaktion.
| Forsøgsoversigt | Mg | Ag | Cu | Zn | Fe |
| MgCl2 | x | (b) | (b) | (b) | (b) |
| AgNO3 | f | x | (b) | (b) | (b) |
| CuCl2 | f | f | x | (b) | (b) |
| ZnSO4 | f | f | f | x | (b) |
| FeSO4 | f | f | f | f | x |
| HCl | f | f | f | f | f |
Fremgangsmåde
Detaljer om hvordan de enkelte forsøg skal udføres.
- Først finder vi de 2 stoffer der skal indgå i forsøget, en i fast form og en i opløst (ion) form.
- Derefter hælder vi ion opløsningen over i et reagensglas
- Nu putter vi så den faste stof i reagensglasset.
- Bestemmelse af resultat
- Det kan godt være svært at bestemme om der er tale om en positiv eller negativ reaktion. Nogle stoffer har ikke en særlig tydelig reaktion, dette kan f.eks. skyldes overflade belægninger der bliver dannet i kontakt med ilt. Andre reaktioner kan være svære at vurdere fordi reaktionen forløber langsomt. I det fleste tilfælde vil man se at vandet bliver grumset eller at der kommer en ny overflade belægning på det nedsænkede metal. Det kan ses på at metallet bliver mindre eller helt forsvinder. Overordent set kan man vurdere at der sker en reaktion hvis metallet eller væsken skifter farve, konsistens eller på anden måde ændrer sig.
Resultater
Oversigt over de forsøg som vi har udført og vil benytte til at eftervise spændingsrækken.
- +
- Positivt resultat observeret fra forsøg.
- -
- Negativt resultat observeret fra forsøg.
- x
- Forsøget er ikke relevant.
- (+/-)
- Resultat giver sig selv fordi modstående forsøg er udført.
- F.eks: Når MgCl2 + Ag giver en reaktion, kan AgNO3 + Mg ikke give en reaktion.
| Resultatstabel | Mg | Ag | Cu | Zn | Fe |
| MgCl2 | x | (-) | (-) | (-) | (-) |
| AgNO3 | + | x | (+) | (+) | (+) |
| CuCl2 | + | - | x | (+) | (+) |
| ZnSO4 | + | - | - | x | (-) |
| FeSO4 | + | - | - | + | x |
| HCl | + | - | - | + | + |
Reaktioner
Mg + AgNO3
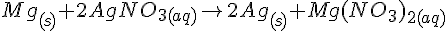
Mg + CuCl2
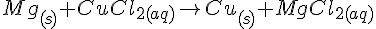
Mg + ZnSO4
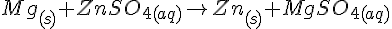
Mg + FeSO4
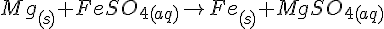
Mg + HCl
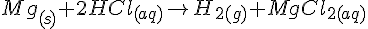
Cu + AgNO3
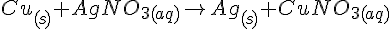
Zn + AgNO3
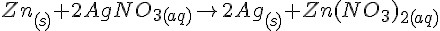
Zn + CuCl2
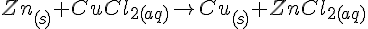
Zn + FeSO4
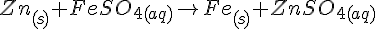
Zn + HCl
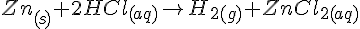
Fe + AgNO3
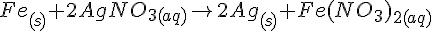
Fe + CuCl2
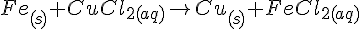
Fe + HCl
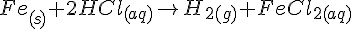
Spændingsrække
Spændingsrækken, sammensat ud fra de forsøg, vi har udført.
Vi har sammensat denne spændingsrække ved at sammenligne de forskellige reaktioner. Det betyder, at stofferne er placeret højere oppe ad ranglisten end dem de reagerer med og længere nede end dem de ikke reagerer med.
- Mg
- Zn
- Fe
- H
- Cu
- Ag
- Magnesium er placeretlængst oppe, fordi det reagerer med alle stofferne. Det betyder, at alle de andre stoffer har en større tiltrækningskraft på elektronerne end magnesium. Det betyder også, at magnesium korregerer/oxiderer meget lettere end de andre stoffer.
- Eks.
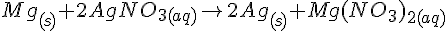
- Her er det sølvchlorid, der tiltrækker elektronerne, så derfor ender magnesium med at blive til en ionforbindelse.
- Næsten det samme gælder for zink, for den reagerer med alle undtagen magnesium. Dermed kan vi placere zink på en 2. plads. Vi kan se, at zink ikke reagerer med magnesium ved at zink ikke oxiderer i forbindelse med en magnesiumopløsning.
- Vi kan placere jern på en 3. plads, fordi det ikke reagerer med zink og dermed heller ikke med magnesium, men det reagerer derimod med de andre stoffer og danner bundfald og en sort belægning på jernspånerne.
- Vi kunne ikke fra starten placere hydrogen, fordi vi ikke kunne stikke et stykke hydrogen ned i nogle opløsninger. Men vi kunne bruge vores saltsyre (HCl) til at reagere med de andre. Saltsyren trak nemlig elektroner fra jern, zink og magnesium, men saltsyren ikke trække elektroner fra de ædle metaller som kobber og guld. Dermed fandt vi, at hydrogen lander på en 4. plads.
- Kobber kom på en 5. plads, fordi den reagerede med guld, men derimod ikke med alle de andre. Igen betyder det, at kobber har en større tiltrækningskraft på elektronerne end magnesium, zink, jern og hydrogen.
- Til sidst er der guld, som er det mest ædle metal, vi har. Det betyder, at metallet holder rigtig meget på sine elektroner og ikke vil reagere med kobber og de forige metaller og stoffer.
Vurdering
Hvis vi kigger på den spændingsrække som vi har sammensat, og sammenligner denne med den reelle og rigtige spændingsrække i lærebogen side 136, burde vi kunne se om vore resultater er korrekte. Rækkefølgen for vores række siger; Mg, Zn, Fe, H, Cu og Ag, og det stemmer fuldstændigt overens med bogens spændingsrække, derfor må vi kunne vurdere at vore forsøg og resultater er korrekte.
Konklusion
Vi kan konkludere at det er muligt at bestemme spændingensrækken udfra nogle forsøg. Skulle man gentage dette forsøg kunne man evt. forbedre det, ved at lave nogle forsøg der underbyggede den teori vi arbejdede med. I vores forsøg har vi bestemt spændingsrækken for nogle stoffer, men vi har ikke bevist teorien der ligger bag spændingsrækken. Dette kunne man evt. gøre ved at lave kontrol forsøg for at se om et stof der reagerede med et opløst stof, ikke ville reagere hvis tilstandsformen ved indledning af forsøget var omvendt.
Det skal også sige at man kan gøre resultatet fra forsøgene mere tydeligt. Hvis man f.eks. fjerner overflade belægninger på metallerne. Disse overflade belægninger kan ved nogle stoffer blive dannet når stoffet er i kontakt med ilt, f.eks. Zink. Man kan også tydelig gøre resultatet ved at øge overfladen på metallet. I stedet for at nedsænke en lille jern kugle, kunne man f.eks. bruge nogle jern spåner. Fordi den samlede overflade af x gram jern spåner er større en den samlede over flade af x gram jern kugle. Og når overfladen er større er kontakten til omkringlæggende væske meget større. Det er også muligt at jern spåner vil gøre resultatet mere udtydeligt, hvis der f.eks. kun er tale om en svag reaktion der kun er synligt på jernets overflade. I sådanne tilfælde kunne resultatet tydeligt gøres ved at benytte jern med en forholdsvis blank overflade (ikke overflade behandlet !).

