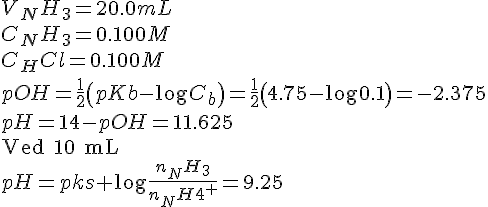Opgave 54
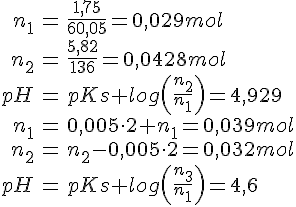
Opgave 55
A og B fordi deres pKs er tæt på 7.
Opgave 57
25,0mL af en eddikesyreopløsning titeres med 0,100M NaOH med phenolphthalein som indikator. Ved indikatoromslaget er der tilsat 15,3mL af NaOH-opløsningen.
- Beregn eddikesyreopløsningens koncentration
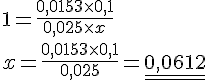
Opgave 58