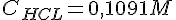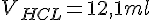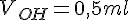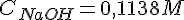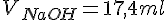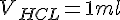Kemi aflevering om rengøringsmidler
Indholdsfortegnelse |
Formål
Af Jonas F. Jensen.
Formålet med øvelsen er at øge bekendskab og praktisk erfaring med pH beregning og titrering. Gennem analyse af saltsyre, natrium- og kaliumhydroxid i flydende afløbs- og wc-rens, med henholdvis kolorimetrisk og potentiometrisk tirering.
Teori
pH beregning
Af Klaus H. Petersen.
pH er bestemt ud fra koncentrationen af oxoniumioner i en opløsning. pH i sig selv beregnes ud fra formlen der lyder:
![LaTex: pH = -log[H_3O^+]](../cache/mimetex-0731b1c3c40f06f344577fc570790171.gif)
Eks
0.1 M HCl
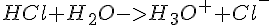
I denne opløsning vil 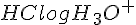 være det samme da forholdet er 1:1, så man kan tage koncentrationen fra HCl og sætte det ind i formlen:
være det samme da forholdet er 1:1, så man kan tage koncentrationen fra HCl og sætte det ind i formlen:
![LaTex: pH = -log[0.1] = pH 1](../cache/mimetex-4e1c3becb263c913db268479c63b6668.gif) Men hvis man nu har en basisk opløsning vil der ikke blive lavet oxoniumioner, der vil blive dannet hydroxiioner(
Men hvis man nu har en basisk opløsning vil der ikke blive lavet oxoniumioner, der vil blive dannet hydroxiioner(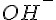 ), men man skal jo kende koncentrationen af
), men man skal jo kende koncentrationen af 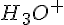 for at kunne udregne pH men man kan benytte videnen om forholdet mellem de 2 ioner, for i rent vand vil koncentrationen af de 2 være det samme:
for at kunne udregne pH men man kan benytte videnen om forholdet mellem de 2 ioner, for i rent vand vil koncentrationen af de 2 være det samme:
![LaTex: [H_3O^+] = 1,0 \cdot 10^-7 M](../cache/mimetex-ccf624740b666522b3b2af420109ddb0.gif) og
og ![LaTex: [OH^-] = 1,0 \cdot 10^-7 M](../cache/mimetex-d952a2acba6a8cc5db26cdf631343639.gif)
så ud fra det kan man opstille en formel som kan omregne koncentrationen af 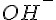 til
til ![LaTex: [H_3O^+]](../cache/mimetex-3f04897ab017b0f86a076f1e6e3ac68d.gif) :
:
![LaTex: [H_3O^+] = \frac{ 1,0 \cdot 10^-14 M^2 }{ [OH^-] }](../cache/mimetex-3451d9f594cde8b94bf94d0287a65190.gif)
En ting der er god at huske på er disse 3 ting:
![LaTex: [H_3O^+] > [OH^-]](../cache/mimetex-3a9fc358c01130d77ecb5b6ec82ddfe5.gif) = sur opløsning
= sur opløsning
![LaTex: [H_3O^+] = [OH^-]](../cache/mimetex-097f1721c0cdcf15d23b63f19cf5ef63.gif) = neutral opløsning
= neutral opløsning
![LaTex: [H_3O^+] < [OH^-]](../cache/mimetex-2846b2b6b678f0699511110af1414b0b.gif) = basisk opløsning
= basisk opløsning
Kolorimetrisk titrering
Af Morten M. Elmholt.
Indikator
Potentiometrisk titrering
Af Morten M. Elmholt.
Udførelse
Af Klaus H. Petersen.
Kolorimetrisk titrering
Materialeliste
Apperatur
- 0,5 ml fuldpipetter
- 1,0 ml fuldpipetter
- Små bøgerglas
- Titreringsopstilling
- Konisk kolber
- Magnet og Omrører
Kemikalier
- Wc-rens (med HCl)
- Flydende afløbsrens (NaOH/KOH)
- 0,1 M HCl
- 0,1 M NaOH
- Indikator (Phenolphthalein)
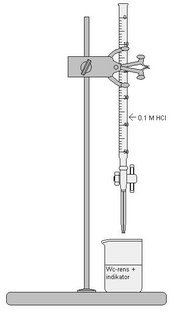
Opstilling
Fremgangsmåde
- Kemikaliet der puttes i en konisk kolbe(henholdsvs 1,0 ml Wc-rens og 0.5 ml afløbsrens)
- Der tilsættes ca 20 ml demineraliseret vand og 5-10 dråber indikator.
- Fyld buretten med 0,1 M HCl(Til Afløbsrens) eller NaOH(til Wc-rens)
- Fjern luft fra buretten og nustil
- Titrær indtil ækvivalens punktet er fundet
- Aflæs buretten og noter den afmålte mængde HCl
- Gentag forsøget endnu en gang
Potentiometrisk titrering
Materialeliste
Apperature
- 0,5 ml fuldpipetter
- 1,0 ml fuldpipetter
- Små bøgerglas
- Titreringsopstilling
- Konisk kolber
- Magnet og Omrører
- pH-meter
Kemikalier
- Wc-rens (med HCl)
- 0,1 M HCl
- Buffer
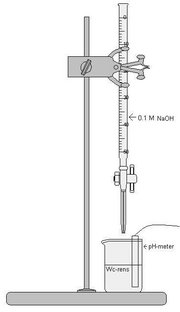
Opstilling
Fremgangsmåde
- 1,0 ml wc-rens hældes op i et bægerglas
- Tilsæt ca 20 ml demineraliceret vand og sæt omrøring på
- Kalibrer pH-meteret
- Placer elektroden fastgjort i et stativ
- Fyld buretten med 0.1 M NaOH
- Aflæs pH
- Tilsæt 1 ml og aflæs igen(Dett gentages indtil man nærmer sig ækvivalens punktet)
- Tilsæt kun 0.1 ml omkring ækvivales punktet
- Når ækvivalens punktet er passeret tilsæt nu 1 ml igen indtil der er tilsat 25 ml NaOH
Resultater
Af Jonas F. Jensen.
Kolorimetrisk titrering af afløbsrens
Se udregnings eksempler for koncentrations beregningen under databehandlings afsnittet.
| Forsøg | V. afløbsrens | C. HCl | V. HCl | C. KOH/NaOH |
| 1 | 0,5 ml. | 0,1091 M. | 12,1 ml. | 2,64 M |
| 2 | 0,5 ml. | 0,1091 M. | 13,0 ml. | 2,84 M |
- Gennemsnitlig koncentration
- 2,74 M
Kolorimetrisk titrering af wc-rens
Se udregnings eksempler for koncentrations beregningen under databehandlings afsnittet.
| Forsøg | V. wc-rens | C. NaOH | V. NaOH | C. HCl |
| 1 | 1 ml. | 0,1138 M. | 17,4 ml. | 1,98 M |
| 2 | 1 ml. | 0,1138 M. | 15,1 ml. | 1,72 M |
- Gennemsnitlig koncentration
- 1,85 M
Potentiometrisk titrering wc-rens
Følgende resultater er opnået med en NaOH koncentration på 0,1138 M og en 1,0 ml. wc-rens.
| V. NaOH | pH |
| 0,0 ml. | 1,40 |
| 1,0 ml. | 1,40 |
| 2,0 ml. | 1,43 |
| 3,0 ml. | 1,48 |
| 5,0 ml. | 1,56 |
| 7,0 ml. | 1,64 |
| 10,0 ml. | 1,89 |
| 12,0 ml. | 2,20 |
| 15,0 ml. | 9,70 |
| 17,0 ml. | 11,61 |
| 22,0 ml. | 11,99 |
| 25,0 ml. | 12,19 |
- HCL koncentration
- 1,707 M
Fortynding af afløbsrens
| Fortynding: | 10^0 | 10^-1 | 10^-2 | 10^-3 | 10^-4 | 10^-5 |
| C. NaOH | 2,74 M | 2,74*10^-1 M | 2,74*10^-2 M | 2,74*10^-3 M | 2,74*10^-4 M | 2,74*10^-5 M |
| pH (målt) | - | 13,0 | 12,6 | 11,6 | 10,5 | 9,3 |
![LaTex: \small{[H_2O^+]}](../cache/mimetex-5e08a387133b09b72e7801a5daff04bd.gif) | 3,649*10^0 | 3,649*10^-1 | 3,649*10^-2 | 3,649*10^-3 | 3,649*10^-4 | 3,649*10^-5 |
| pH (beregnet) | 14,438 | 13,438 | 12,438 | 11,438 | 10,438 | 9,438 |
Beregning af pH
For at finde pH værdien skal vi beregne ![LaTex: [H_3O^+]](../cache/mimetex-3f04897ab017b0f86a076f1e6e3ac68d.gif) koncentrationen:
koncentrationen:
![LaTex: [H_3O^+] = \frac{10^{-14}}{[C_{NaOH}]}](../cache/mimetex-f8bddd268315dab295088ffeaf87c389.gif)
Dernæst skal vi bare tage minus log() af denne koncentration:
![LaTex: pH = -log([H_3O^+])](../cache/mimetex-ccf6c081760281b7e79ca2bf619620b8.gif)
Fortynding af wc-rens
| Fortynding: | 10^0 | 10^-1 | 10^-2 | 10^-3 | 10^-4 | 10^-5 |
| C. HCL | 1,85 | 1,85*10^-1 M | 1,85*10^-2 M | 1,85*10^-3 M | 1,85*10^-4 M | 1,85*10^-5 M |
| pH (målt) | - | 1,2 | 2,0 | 2,9 | 3,8 | 4,7 |
![LaTex: \small{[H_2O^+]}](../cache/mimetex-5e08a387133b09b72e7801a5daff04bd.gif) | 1,85 | 1,85*10^-1 M | 1,85*10^-2 M | 1,85*10^-3 M | 1,85*10^-4 M | 1,85*10^-5 M |
| pH (beregnet) | -0,267 | 0,733 | 1,733 | 2,733 | 3,733 | 4,733 |
Beregning af pH
For at finde pH værdien skal vi kende ![LaTex: [H_3O^+]](../cache/mimetex-3f04897ab017b0f86a076f1e6e3ac68d.gif) koncentrationen, i denne blanding er
koncentrationen, i denne blanding er ![LaTex: [H_3O^+]](../cache/mimetex-3f04897ab017b0f86a076f1e6e3ac68d.gif) koncentrationen det sammen som [HCL] koncentrationen. Derfor kan vi bare tage -log() af [HCL] koncentrationen.
koncentrationen det sammen som [HCL] koncentrationen. Derfor kan vi bare tage -log() af [HCL] koncentrationen.
![LaTex: pH = -log([HCL])= -log([H_3O^+])](../cache/mimetex-dfe7e80fb535505c1100ae8e88ec04c2.gif)
Databehandling
Af Jonas F. Jensen.
Beregning af koncentration i afløbsrens
Vi kender nu:
For at beregne koncentrationen af KOH/NaOH, skal vi finde stof mængden for KOH/NaOH, og volumen fordi:
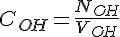
Vi går udfra at stofmængden for KOH/NaOH er lig med stofmængden for HCL ved ækvivalenspunktet. Vi og vi kan beregne stof mængden for KOH/NaOH og HCL på følgende måde:
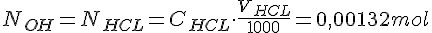
Nu kan vi udregne koncentrationen for KOH/NaOH ved at sætter formlerne ind i hinanden:
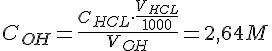
Beregning af koncentrationer i wc-rens
Vi kender nu:
For at beregne koncentrationen af HCL, skal vi finde stof mængden for HCL, og volumen fordi:
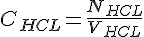
Vi går udfra at stofmængden for HCL er lig med stofmængden for NaOH ved ækvivalenspunktet. Vi og vi kan beregne stof mængden for NaOH og HCL på følgende måde:
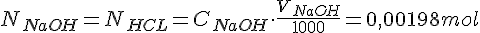
Nu kan vi udregne koncentrationen for HCL ved at sætter formlerne ind i hinanden:
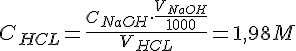
Titreringskurve for potentiometrisk titrering
Beregnet kurve
Vurdering
Af Jonas F. Jensen.
Fejlkilder
(Farveblindhed)
Konklusion
Af Klaus H. Petersen.
Vi kan konkludere ud fra dette forsøg at formålet med at øge vores bekentskab til pH beregning og titrering er blevet opnået forholdsvis godt. Da det giver en meget bedre forståelse når man kan se det i praksis igennem en analyse. Kendskabet til indikator er også blevet noget bedre da vi selv skulle vælge vores indikator til den kolorimetrisk titrering.