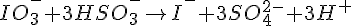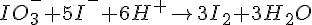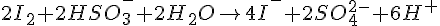Landolts reaktionshastighedsforsøg
Forsøg med reaktions hastigheder, udført som klasse forsøg.
Indholdsfortegnelse |
Afstemning af redoxreaktioner
Iodat koncentration
- Forsøg 1
![LaTex: [IO_3^{-}] = \frac{0,04\cdot 0,1}{0,25} = 0,016 M](../cache/mimetex-68821fc45b1486cf0cfe6646f99835ee.gif)
- Forsøg 2
![LaTex: [IO_3^{-}] = \frac{0,08\cdot 0,1}{0,25} = 0,032 M](../cache/mimetex-86bdaa53961f034222097384fb3235a0.gif)
- Forsøg 3
![LaTex: [IO_3^{-}] = \frac{0,16\cdot 0,1}{0,25} = 0,064 M](../cache/mimetex-248a0d3443e97c386423a0272c927079.gif)
- Forsøg 4
![LaTex: [IO_3^{-}] = \frac{0,08\cdot 0,1}{0,25} = 0,032 M](../cache/mimetex-86bdaa53961f034222097384fb3235a0.gif)
- Forsøg 5
![LaTex: [IO_3^{-}] = \frac{0,08\cdot 0,1}{0,252} = 0,0317 M](../cache/mimetex-47bd0a338588f14ab401584549cefb23.gif)
Hydrogensulfit koncentration
- Forsøg 1-4
![LaTex: [HSO_3^{-}] = \frac{0,025\cdot 0,025}{0,25} = 0,0025 M](../cache/mimetex-134e03223c66ac4bc2be4c5fa28cb586.gif)
- Forsøg 5
![LaTex: [HSO_3^{-}] = \frac{0,025\cdot 0,025}{0,252} = 0,00248 M](../cache/mimetex-8fb8851ddc073796ff4b744b20dd349e.gif)
Hastighedsudtrykket
Der skal stå minus foran den aktuelle hydrogensulfitkoncentrationsændring, fordi koncentrationsændringen er negativ. Der ikke er mere hydrogensulfit tilbage i blanding når forsøget afsluttes, derfor er koncentrations ændringen negativ.
- Hastighedsudtryk
![LaTex: v = \frac{ - \Delta [HSO_3^{-}]}{\Delta t}](../cache/mimetex-d6fe968bd0e7d6fa492956329f7aadf5.gif)
Gennemsnitlig reaktionshastighed
- Forsøg 1
![LaTex: v = \frac{[HSO_3^{-}]}{115} = 2,174\cdot 10^{-5}\frac{M}{s}](../cache/mimetex-2be56bf05e2836d93f889209a5dbfbe8.gif)
- Forsøg 2
![LaTex: v = \frac{[HSO_3^{-}]}{64} = 3,906\cdot 10^{-5}\frac{M}{s}](../cache/mimetex-fb486fa3d75ce25e8b0d5646d3a40b86.gif)
- Forsøg 3
![LaTex: v = \frac{[HSO_3^{-}]}{36} = 6,944\cdot 10^{-5}\frac{M}{s}](../cache/mimetex-7f66d97ee93e852cbd1dcc30efd19dca.gif)
- Forsøg 4
![LaTex: v = \frac{[HSO_3^{-}]}{41} = 6,098\cdot 10^{-5}\frac{M}{s}](../cache/mimetex-e70f411b6b5c055804ad7c3673dfde83.gif)
- Forsøg 5
![LaTex: v = \frac{[HSO_3^{-}]}{0,44} = 5,636\cdot 10^{-3}\frac{M}{s}](../cache/mimetex-6697664ac245bbbd315ff1b53813870e.gif)
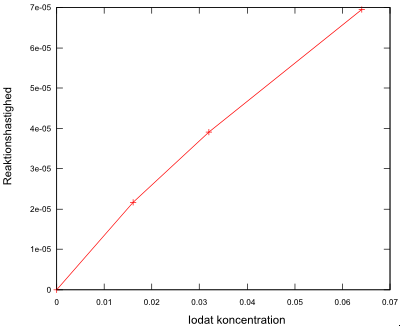
Reaktionshastighed som funktion af iodat koncentration
Der burde ikke være nogen b i formlen ax+b, da der ikke er nogen reaktion uden iodat koncentration.
![LaTex: v([IO_3^{-}]) = 1,069\cdot 10^{-3}\cdot [IO_3^{-}] + 2,62\cdot 10^{-6}](../cache/mimetex-970b4e98d8e2ac4449a8e39f2887871d.gif)
- Hvis den aktuelle iodat koncentration er positiv.
Sammenligning af forsøg 2 og 4
I begge forsøg er der de sammen koncentrationer, men ikke samme temperatur. Derfor kan man konkludere at temperaturen påvirker reaktionshastigheden.
Sammenligning af forsøg 2 og 5
Der er tale om at at HCl virker som katalysator, der får reaktionen til at løbe hurtigere. Der er tale om en homogen katalysator, da den har samme fasetilstand som resten af opløsningen.