Oxidation

| Kemi
Dette er en artikel der er relateret til faget kemi. |
Indholdsfortegnelse |
Oxidationstal
Oxidationstallet er et udtryk for hvor mange elektroner et grundstof helt eler delvist har afgivet.
Eksempel
Oxidationstal skrive som romertal over stoffet/ionen.
- Cu
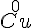
- Cu
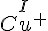
- Cu
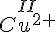
- S
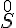
- S
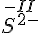
- Regl
- For simple ioner er oxidations tallet = med ladningen.
Sammensatte ioner
- Regler
- OT = Oxidationstal
- Når oxygen er bundet til at et mindre elektronegativt stof har det OT=-II
- Når hydrogen er bundet til at mere elektronegativt stof har det OT=+I
- Summen af OT for alle stoffer i et sammensat stof skal give stoffets ladning.
- Eks
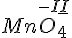
- Du ved at O her OT på -II (se regle 1).
- Du ved at stoffets samlede OT er -I, derfor skal OT for Mn være 7 fordi
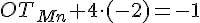
Organiske stoffer
I organiske stoffer kan man godt ignorer ubetydelige grupper som f.eks. 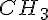 i
i 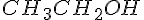 , så man kun leger med
, så man kun leger med 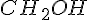 .
.

