PH begrebet

| Kemi
Dette er en artikel der er relateret til faget kemi. |
Kemisk forklaring af begrebet pH.
Indholdsfortegnelse |
Vand ion produkt
Vand kan både afgive og modtage en elektron til og fra sig selv. Her beregnes koncentrationen af OH og H3O i rent vand. Hvis man så tilfører yderlige OH, eller H3, vil den ikke være neutral længere og bliver til syre eller base.
- vands autoprotolyse
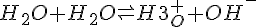
- Giver en ligevægt på (ved 25° C)
![LaTex: K_v = \frac{[H_3O^+]\times[OH^-]}{[H_2O]^2} = [H_3O^+]\times [OH^-]=1,0\times10^{-14} M^2](../cache/mimetex-b444c79343b3ef6b4a0891ce7482f91f.gif)
- Man dividere ikke med [H2O]^2 fordi ændringen til H3O og OH sker så sjælent at [H2O] næsten er 1.
- OH vs H3O
![LaTex: \fbox{[OH^-]\times[H_3 O^+]=10^{-14}M^2](../cache/mimetex-5cc53d672f2ef00b6b6fd9c4a53a3cbb.gif)
Koncentration til pH
![LaTex: \fbox{pH = -\log([H_3O])}](../cache/mimetex-25db5adbf9d391926e2367170bce0ce5.gif)
- Tip
- P'et i ph betyder minus log = -log().
pH for vand ved 25° C
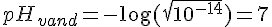
pH på saltsyre
- Saltsyre med en koncentration på 0,012 M
- Salt syres reaktion med vand
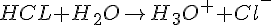
pH på NaOH
- NaOH opløsnings på 1 M
![LaTex: [OH^-] = 1M](../cache/mimetex-56fb5030c5dd1a1e98c55483130c8b9e.gif)
![LaTex: [H_3O^+] = \frac{10^{-14}}{[OH^-]}=10^{-14} M](../cache/mimetex-73a0f1df77172f6f645c8a9621556048.gif)
![LaTex: pH = -\log([H_3O^+]) = 14](../cache/mimetex-e5a8533f311b965bf8230a14ec12225d.gif)
pOH
![LaTex: [H_3 O^ + ] \times [OH^ - ] = 10^{ - 14} \\ - \log [H_3 O^ + ] - \log [OH^ - ] = 14 \\ pH + pOH = 14 \\ pH = - \log [H_3 O^ + ] \\ pOH = - \log [OH^ - ] \\](../cache/mimetex-599ee477149ca57a9f1c1404f52092f0.gif)
![LaTex: [H_3O^+] = 0,012 M](../cache/mimetex-65abce4f1645fe1285465b13856fffc2.gif)
![LaTex: pH = -\log([H_3O^+]) = 1,92](../cache/mimetex-45dfed3928cd96516146a50864a04f95.gif)

