Reaktionshastighed (Kemi)

| Kemi
Dette er en artikel der er relateret til faget kemi. |
Handler om hvor hurtigt en reaktion forløber.
- Definition
- Koncentrations ændring pr. tids enhed. Molær/s
- Reaktions hastigheden afhænger af
- Reaktant koncentration (Tryk ved gas reaktion)
- Ved heterogen reaktion, overflade areal.
- Temperatur.
- katalysator/inhibitor (enzymer).
- Reaktionershastighed
![LaTex: v =k\cdot [Produkt]\cdot [Reaktant]\cdots](../cache/mimetex-c2a9d4d505be904bab41ecb05cb078a6.gif)
- k = temperatur og reaktions afhængig konstant.
- v = reaktionshastighed ved en givet koncentration.
Reaktions mekanisme
- A = Reaktant
- B = Reaktant
- C = Produkt
- D = Produkt
- E = Produkt
- Brutto reaktion
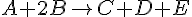
- Elementar reaktioner
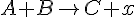 (bimolekylær)
(bimolekylær)
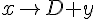 (unimolekylær)
(unimolekylær)
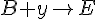 (bimolekylær)
(bimolekylær)
- Hvor x og y er mellem produkter, altså midlertidige produkter som reagerer hurtigt med noget andet igen.
Den langsomste reaktions hastighed afgøre den samlede reaktions hastighed.
Eksempel
En grafisk afbildning af koncentrationerne i dette forsøg over tid, vil være eksponentiel.
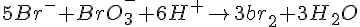
- Start
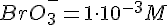
- Br g H e i overskud, så BrO3 er begrænsende faktor.
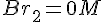
- Slut
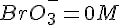
- Br g H e i overskud, så BrO3 er begrænsende faktor.
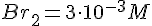
- Koncentration ændrings hastigheden
![LaTex: v = \frac{\Delta [Br_2]}{\Delta t}](../cache/mimetex-fdce61762303cdd34dd738b16c3b819c.gif)
- (Ps. da en eventuel graf vil være eksponentiel, vil v afhænge af hvor på grafen man aflæser delta t og delta koncentration).
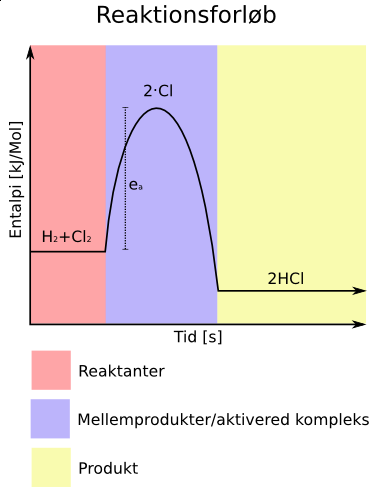
Reaktionsforløbs eksempel (HCl)
- Bruttoreaktion
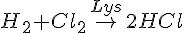
- Reaktionsmekanisme
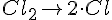 (Unimolekylær)
(Unimolekylær)
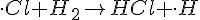 (Bimolekylær)
(Bimolekylær)
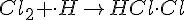 (Bimolekylær)
(Bimolekylær)
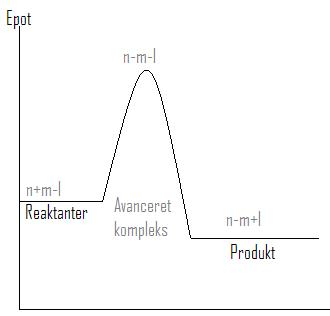
- ea er aktiveringsenergien.
- Note
- Man skal lave et energi diagram for hver reaktions mekanisme, den der kræver mest aktiverings energi, bestemmer aktiverings energien for hele reaktionen.