Spændingsrækken
Spændings rækken har betydning for hvor let forskellige metaller reagere med hinanden.
K Ba Ca Na Mg Al Zn Fe Pb (H2) Cu Ag Pt Au e afgives let e afgives kan vanskeligt Reaktionsvillige Ædel metaller
Jern kan ikke stjæle elektroner fra Cu fordi Cu er mindre reaktions villig end Jern. Derfor vil 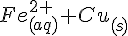 ikke overfører elektroner til Jern så det kan blive fast. Cu kan derimod godt stjæle elektroner fra Jern
ikke overfører elektroner til Jern så det kan blive fast. Cu kan derimod godt stjæle elektroner fra Jern 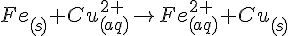 .
.
Flot tabel
| Metaller | Metalioner | Reaktivitet |
|---|---|---|
| K | K+ | Reagerer med vand |
| Na | Na+ | |
| Li | Li+ | |
| Ba | Ba2+ | |
| Sr | Sr2+ | |
| Ca | Ca2+ | |
| Mg | Mg2+ | Reagerer med syrer |
| Al | Al3+ | |
| Mn | Mn2+ | |
| Zn | Zn2+ | |
| Cr | Cr2+ | |
| Fe | Fe2+ | |
| Cd | Cd2+ | |
| Co | Co2+ | |
| Ni | Ni2+ | |
| Sn | Sn2+ | |
| Pb | Pb2+ | |
| H2 | H+ | Ikke et metal (kun med til sammenligning) |
| Sb | Sb2+ | Ædle metaller (reagerer helst ikke) |
| Bi | Bi2+ | |
| Cu | Cu2+ | |
| Hg | Hg2+ | |
| Ag | Ag+ | |
| Au | Au3+ | |
| Pt | Pt+ |
Undergrupperinger
K Ba Ca Na
- Reagere med vand under brint udvikling
K Ba Ca Na Mg Al Zn Fe Pb
- Metallerne reagere med fortynet syre under brint udvikling.
Cu Ag Pt Au
- Opløses ikke i fortynet syre, men for at oxidere ædel metallerne skal der bruges meget stærke midler.

