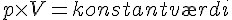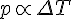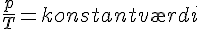Idealgasloven

| Kemi
Dette er en artikel der er relateret til faget kemi. |
artikel om idealgasloven, UPS denne artikel bruges både i Fysik og Kemi.
Indholdsfortegnelse |
Idealgasloven
- N = newton.
- F = kraft i N
- a = areal i m².
- Pa = Pascal (tryk) = F/a = N/m².
- Bar = 10⁵ Pa
- L = Liter
- K = Kelvin (temp)
- Atm = atmosfære ca. 1,013 bar
- R = gas konstanten = 0,0831 (L*bar)/(Mol*K) eller 0.082 (L*Atm)/(Mol*K)
- T = temperatur i kelvin
- n = stof mængde i Mol
- V = volume i Liter (ved 1 Atm og 293 Kelvin, er V for en Mol gas = 24 Liter).
- p = Tryk i bar
- p*V = n*R*T
Versioner
Der findes flere forskellige versioner af idealgasloven, med forskellige enheder.
L*Atm
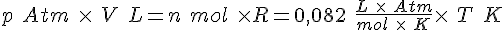
J
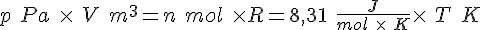
- Fordi
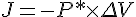 (P i Pa og V i m³; dette kan bruges i andre sammenhæng)
(P i Pa og V i m³; dette kan bruges i andre sammenhæng)
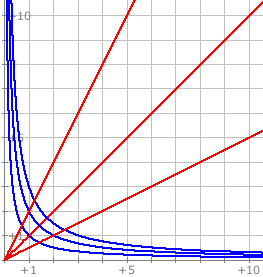
P,T og V
Følgende kan udtrækkes fra idealgasloven.
Tilstandsligningen
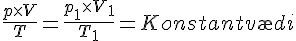
Se evt.
Kategorier: Kemi | Fysik