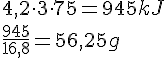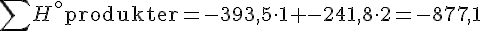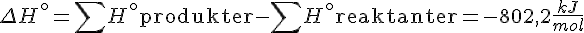Kemi opgave 9.1-9.3 entalpi
Se evt: Entalpi.
Indholdsfortegnelse |
Opgave 9.1
Beregning på forbrænding af methan.
Reaktion
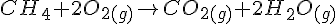
Entalpi
Reaktanter:
- CH4(g)
- -74,9
- 02(g)
- 0
Produkter:
- CO2(g)
- -393,5
- H2O(g)
- -241,8
Resultater
Derved kan vi konkludere at reaktionen er exoterm.
Omregning til kg
- CH4 Vægt
- 16,04 U = 16,04 g/mol.
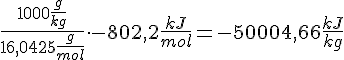
Opgave 9.2
- Delopgave 1
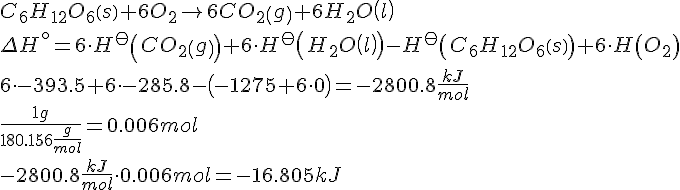
- Delopgave 2
- Det stemmer meget godt.
- Delopgave 3