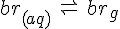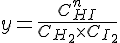Ligevægt kemi

| Kemi
Dette er en artikel der er relateret til faget kemi. |
Ligevægt betyder at reaktionens hastigheden mod højre og venstre i reaktions skemaet er ens. Og der er ingen ændring i de aktuelle koncentrationer.
Indholdsfortegnelse |
Ligevægts notation
Hvis man har et lukket system, med f.eks. br og H2O vil man normalt snakke om at noget af den br der er, er i gas form og noget i opløstform (g) og (aq). Men i betyder det blot at disse 2 reaktioner foregår på sammen tid og i samme hastighed:
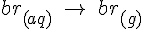
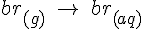
Disse 2 reaktioner som foregår i sammen hastighed i begge retninger kan noteres som:
Mængden af henholdsvis br(aq) og br(g) er hele tiden konstant i det lukkede system.
Reaktionsbrøk
Ved ligevægt i systemet har reaktionsbrøken en konstant værdi.
 Koefficenten for produktet.
Koefficenten for produktet.
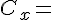 koncentrationen af produktet.
koncentrationen af produktet.
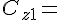 Koncentrationen af den første reaktant.
Koncentrationen af den første reaktant.
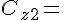 Koncentrationen af den 2. reaktant.
Koncentrationen af den 2. reaktant.
- Reaktionenbrøk
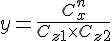
(Hvis der er flere reaktanter ganger man dem bare på).
Formulering af reaktionsbrøken
Forklaring af reaktionsbrøken ved brug af ord.
Produkternes koncentrationer skrives i tælleren og reaktanternes koncentrationer skrive i nævneren. De enkelte stoffers koncentration opløftens i en potens svarende til koeffienten i reaktionsskemaet, og potens udtrykkene ganges sammen.
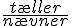
Eksempel
Et eksempel med Hydrogen og Iod.
- Reaktion
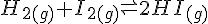
- Reaktionsbrøk
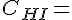 Koncentrationen af HI.
Koncentrationen af HI.
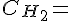 Koncentrationen af H2.
Koncentrationen af H2.
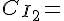 Koncentrationen af I2.
Koncentrationen af I2.
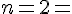 Koefficenten for HI i reaktionen som er 2.
Koefficenten for HI i reaktionen som er 2.
Ligevægtsloven
Ved ligevægt er reaktionens brøken y = kc, hvor kc er en temperatur afhængig stofkonstant.
- Hvis y<kc
- Ikke ligevægt, der omdannes reaktanter til y=kc.
- Hvis y>kc
- Ikke ligevægt, der dannes reaktanter til y=kc.
- Hvis y=kc
- Ligevægt, nu foregår reaktionen i samme hastighed i begge retninger.
Indgreb i ligevægt system
Hvis man har et kemisk system i ligevægt er der 3. forskellige indgreb man kan lave. (Katalysator kan ændrer på hastigheden i reaktionen ikke i ligevægts konstanten kc og dermed heller ikke i koncentrationerne)
Ændring af koncentration
Ændring af koncentrationerne i blandningen, vil medfører en ændring i reaktionsbrøken fordi den er afhængig af koncentrationerne. Dermed ændres det sted hvor ligevægten står også.
Ændring af temperaturen
Ændring af temperature påvirker kc og dermed også reaktanter/produkters koncentrationer i blandingen.
Ændring af trykket/volumen
Ændring af trykket ændrer koncentrationerne af reaktanter og produkter, od dette ændrer kc. Hvilket giver sig selv fordi reaktionsbrøken er afhængig af koncentrationerne.