Syrer-baser

| Kemi
Dette er en artikel der er relateret til faget kemi. |
Definition og forklaring af grundlæggende ting om syrer og baser.
- Syrer
- Ion eler molekyle som kan afgive en proton H+
- Base
- Ion eler molekyle som kan modtage en proton H+, (Stoffer der optræder som base har et ledigt elektron par).
- Eks
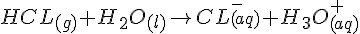
- Ved en syrer base reaktion er det protoner der overføres.
Indholdsfortegnelse |
Almindelige syrer
Navn Formel Styrke Bemærkning Saltsyrer HCL Stærk Findes i mavesækken svovlsyrer H2SO4 Stærk Findes i bilbatterier (diprotsyrer) Salpetersyrer HNO3 Stærk Citronsyrer H3C6O7H5 Svag Finde i citroner og brus tabletter (triprotsyrer) Eddikesyrer CH3COOH Svag Afkalkningsmiddel, konservering Smørsyrer CH3CH2CH2COOH Svag Sure sokker og harsk smør Mælkesyrer HC3O3H5 Svag Dannes i muskler under arbejde, kan også finde i sur mælk. Fosforsyrer H3PO4 Svag Rust og cola Kulsyrer H2CO3 Svag Sodavand, tryk flasker (Ustabil syrer, fordi den bliver til ligevægt med H20 og CO2)
Navne/Omtale
Man kan omtale citronsyrer som triprotsyrer fordi den kan afgive 3 protonerm, og svovlsyrer som diprotsyrer fordi den kan afgive 2. Se evt. Navngivning_Kovalent for mere information om latinske tal.
Styrke
Syrens styrke er syrens evne til at afgive en proton.
Sikkerhed
Hæld aldrig vand i syrer, men du må gerne hælde syrer i vand! Fordi syrer er tungest og derfor ligger det sig i 2 lag hvilket resultere i en exoterm process der sprøjter ud over det hele.

